

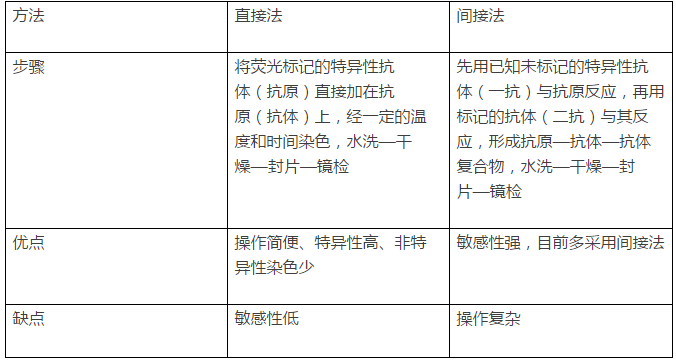
一、实验的常用方法有直接法和间接法,方法的选择是实验的第一步:
二、我们来看看实验的常见问题:
1、整个细胞片都出现荧光亮点?
答:原因有二:一是二抗浓度过高,适当降低二抗浓度即可。
二是二抗发生沉淀,可以使用过滤或者离心荧光标记二抗
2、信号弱或无信号,染色细胞过少?

3、为什么我的镜下观察只有DAPI的蓝光,目的荧光几乎没有或者很弱?
答:出现这种现象很有可能是抗体比例太低,需提高抗体浓度,可配合提高二抗浓度;共聚焦的激发荧光强度不够大;二抗孵育时是否是对应的种属,比如本来需要山羊抗鼠结果加为山羊抗兔
4、为什么我的细胞核周围总是存在有一些蓝色的小点点?
答:此种情况一般是支原体污染所致,建议用杀支原体药2周后再检测,或者通过提高共聚焦机器背景值来覆盖支原体荧光
5、共定位的视野该如何选择?
答:共定位时,首先判断哪些细胞是转染成功的,比如我过表达了蛋白A,想做蛋白A和蛋白B的共定位关系,则在视野中寻找已成功转染蛋白A的细胞,一般荧光强度会显著高于周边其他细胞,再在这个细胞上观察蛋白B的表达,
6、视野中细胞与细胞之间存在散在的发光点。
答:有两种情况可造成:1,拍照时PBS量过少引起的非特异性;2,PBS未过滤,未溶解的残渣黏附而导致
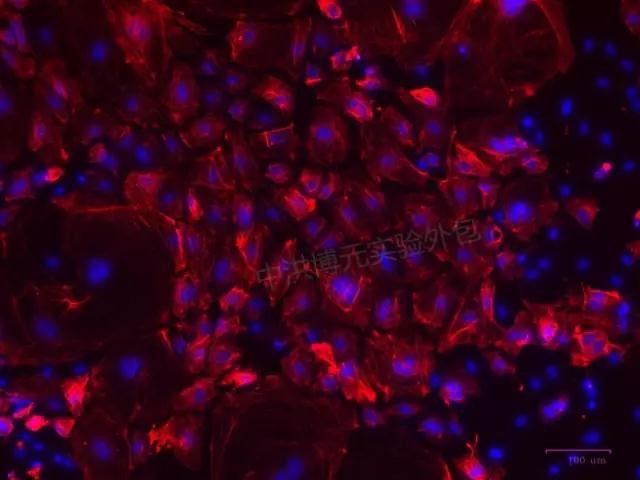
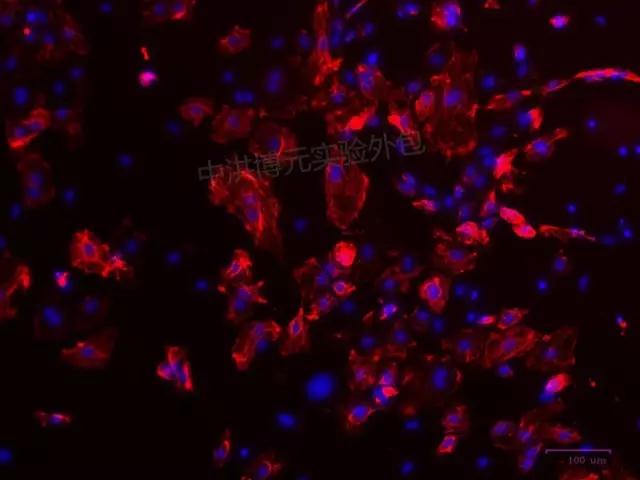
成功免疫荧光如下图:
三、除此之外,这些注意事项也要牢记
1、合适的抗体稀释比例
通过优化抗体稀释比例来优化染色,通常情况下1ug/ml的纯化抗体或者1:100-1:1000的抗血清足够达到特异性染色的结果。但在能保证低背景染色的前提下,可以通过增加浓度来提高信号强度。如果是第一次使用该抗体或测定某抗原,强烈建议浓度梯度实验。
2、抗体特异性
免疫荧光需要用到特异性非常强的抗体,可以避免高背景和不理想的蛋白定位结果。在大多数情况下,纯化抗体的效果很好,但是正确的对照可以帮助精准定位抗原。使用只有二抗染色的片子
3、细胞固定和通透
为达到最佳的检测效果,细胞需要经过固定和通透。这些步骤非常关键,细胞和抗原需要保证最佳的结构,并利于抗体与抗原结合。通常情况下,需要通过以下步骤得以实现:细胞用2%-4%多聚甲醛固定,之后用0.1%皂角苷或0.02%的Triton X-100进行通透。前者是比较温柔的处理,但是对于核内抗原可能无效,需要用到Triton。使用皂角苷进行通透时,要注意它会引起细胞膜的可逆性通透,也就是除了在通透初期,在每个抗体孵育环节都需要进行通透。另外,细胞可以用冰甲醇进行同时固定和通透,可以避免去垢剂的使用。
4、封闭条件的优化选择
为了防止内源性非特异性蛋白抗原的结合,需要在一抗孵育前用封闭液封闭,这样可以减少非特异性的背景着色。封闭液可以选择二抗来源一致的血清,一般来说,血清价格比较昂贵,可以用1%-5%BSA替代,BSA可以说是万能的封闭血清。另外封闭时间不易过长,30-60min即可,且封闭后不用洗涤,直接加一抗孵育即可。
5、一抗二抗的选择
封闭过后需要一抗孵育,可以选择4度过夜孵育或者室温3h,以笔者的经验是一抗孵育4度过夜比较好,抗原抗体结合会比较充分。一抗二抗的稀释比例可以根据抗体说明书来,再根据自己具体的实验要求进行优化。如果抗体浓度过低,会造成信号太弱,如果抗体浓度过高可能会造成背景染色太强。荧光二抗个人感觉Alex flour荧光基团信号强于Dylight强于FITC。如果做免疫双标,一抗要来自不同种属,荧光二抗的光谱也要分开。