

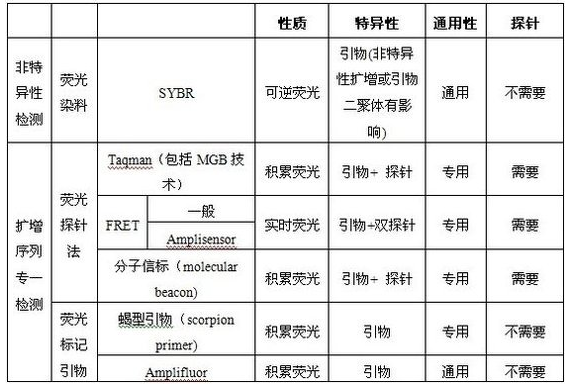
总的说来,荧光检测技术可大致分为两大类:通用型的荧光染料检测法和高特异性的荧光探针法。
前者主要是利用荧光染料(如SYBR Green I)与双链DNA分子结合发光的特性来指示扩增产物的增加,优点是:无需另外设计荧光探针 ,无需特别优化条件,简便易行,成本较低,能适用于任何一款定量 PCR 仪,缺点是专一性不如探针法;
而后者则利用荧光标记的特异性探针或者引物来识别模版,优点是特异性更高,适用于扩增序列专一检测(见下表),不过增加了荧光探针的成本。
除了以上这些,还有双探针系统(bi-probe system)、BODIPY FL标记探针、Light- up探针、iFRET(induced fluorescence resonance energy transfer) 技术、Qzyme 探针和Magiprobe等等。
这么多种荧光标记方法,在选择的时候当然要根据各人实验设备、实验目的以及实验要求,还有经费来判断了。
荧光染料
对于专一性要求不高的实验,或者是大规模高通量的实验,使用方便、花费较小的荧光染料可以作为你初步的选择对象。老实说,荧光染料法实质上无非就是常规的PCR反应中添加了荧光染料,借助染料和双链DNA的结合所发出的荧光实时监控反应的进程。由于不需要设计序列特异性探针和优化反应条件,价格低廉,通用性强,而且荧光染料法可用于任何一种型号的定量PCR仪,因而同样得到广泛采用。荧光染料法的专一性和PCR没有本质的区别---但是作为“失之毫厘,谬之千里”高度精确的实验,你依然可以选择更好的荧光染料、更严谨专一的PCR酶、更好的缓冲体系来提高反应的可靠程度。
在荧光染料法的定量PCR反应试剂中,最常用的是SYBR Green I,这种高灵敏度,较低毒性的核酸染料最大激发波长497nm,最大发射波长是520nm,在结合双链DNA分子后荧光增强800-1000倍,灵敏度较EB更高,毒性较EB低,可避免EB对于小分子量DNA灵敏度较低,而在监测大分子量DNA区域可能会出现背景色等等弱点,因此经过时间的筛选渐渐成为了定量PCR荧光染料的“当家花旦”。
在PCR反应体系中,加入过量SYBR Green I荧光染料,SYBR荧光染料掺入DNA双链后荧光信号显著增强;当DNA变性时SYBR Green I染料释放出来,荧光急剧减少;随后在聚合延伸过程中引物退火并形成PCR产物,SYBR Green染料与双链产物结合,经检测获得荧光的净增量。荧光信号的增加与PCR产物的增加完全同步。
荧光染料可以在反应末尾对扩增产物进行溶解,称为溶解曲线分析。在溶解曲线分析过程中,随着温度从低于产物溶解点缓慢升到高于产物溶解点,定量PCR仪连续监测每个样品的荧光值。基于产物长度和G/C含量的不同,扩增产物会在不同的温度点解链。随着产物的解链就可以看到荧光值的降低并被仪器所测量。对溶解曲线进行微分可以计算出溶解峰。溶解峰可以反映反应中扩增到的产物,因此用溶解曲线数据就可以进行定量监督了。
SYBR的主要优势:
安全性:
SYBR染料的致突变性远低于EB数倍甚至数十倍(取决于不同受检物种或株系)
超高灵敏度:
具有1000倍以上的荧光增强效果和0.6的量子产量;与此相比,EB只有大约30倍的荧光增强效果和0.15的量子产量。因此,SYBR Gold检测核酸的灵敏度是EB的十倍以上。(这主要是因为SYBRGreen是和DNA小沟结合,而EB则是嵌入到碱基之间)
使用电泳后染色程序可提高灵敏度,而渗透入凝胶的速度极快。
通用性:
可在各种类型的凝胶如高浓度琼脂糖、乙二醛琼脂糖、甲酰胺琼脂糖、聚丙烯酰胺和尿素-聚丙烯酰胺凝胶中检测双链DNA。
简便易用:
只须将凝胶在染色液中保温10-40分钟(取决于凝胶的厚度和浓度),无须脱色,背景极低。
与其他分子生物学技术兼容:对酶切、连接和PCR反应都没有影响。
与常规仪器兼容:可用300-495nm的任何类型的光源激发。
适合高通量大规模的定量PCR检测。
使用浓度对荧光PCR结果的影响:
SYBR Green I 的使用浓度是影响实验成功与否的关键因素,如果SYBR Green I的浓度不饱和会使荧光信号不能反应产物量的变化。而过高浓度则会抑制PCR反应,降低PCR反应效率。通常试剂盒会有比较现成的方案。提高镁离子浓度可以降低SYBR Green I对PCR反应的抑制作用。在用SYBR Green I进行荧光PCR反应时, 镁离子浓度要比无SYBR Green I 的普通 PCR 反应要高(0.5-2mM)。
缺点:
然而虽然SYBR Green荧光染料可以用来监测各种双链DNA序列的扩增,灵活性高是它的优点,但是正如一个硬币有两面,通用性高就意味着专一性低,由于荧光染料可以和任何双链DNA结合,因此DNA引物二聚体(primer-dimers)或其它非特异扩增产物(spurious PCR)可以对定量结果产生干扰(导致低Ct值),同时也降低了反应的专一性和可重复性---而这一点对于定量PCR分析十分重要。
舍不得SYBR Green I的方便、通用、便宜的优点,又希望提高其专一性。
许多人做了不少尝试:比如仔细的设计引物和纯化模板、比如使用能分析产物熔解曲线的软件可以解决引物二聚体的问题选择,还有就是采用严格热启动的扩增酶减少非特异扩增、采用特定的缓冲系统减少引物二聚体和错配形成、采用修饰碱基减少二级结构或者改变稳定性、在Tm值以上进行荧光测定减少引物二聚体的影响等等。
提高PCR的特异性已经是老大难问题了,对于贪图方便、便宜的实验新手来说不一定能考虑周全,这也就是为什么许多希望能通过在普通PCR基础上摸索条件,自己完成定量PCR检测的研究人员发现结果不理想的主要原因之一。
因此,不少生物技术公司针对荧光染料特异性缺点使出了各家的法宝,提出了有建设性和有新意的解决方案也让这个荧光检测技术继续焕发光彩。
染料法引物设计
有人会问:「探针法和染料法的引物能不能通用啊 」,一般探针和染料法的引物设计原则上还是有差异的。
探针法的引物设计对于引物二聚体的要求没有染料法严格。我曾经自己是试过,用我探针的引物去做染料法的,但是条件必须要优化才能避免二聚体的生成。不过优化后的结果还是不错的。
但是,如果你拿染料法的引物,去做探针就会有问题了,第一是扩增长度会出现问题,第二是否在探针所在的区间等等,所以建议单独设计。
(本文转载丁香通)