

在实验过程中,由于样品的各种性质差异,只有选择了正确的离心方法,才能获得预期的分离纯化结果。常用的离心方法主要有差速离心法、密度梯度离心法。其中密度梯度离心法又可细分为速率区带离心和等密度梯度离心法。小贝离心学堂将对这三种常用的离心分离方法分别进行专题介绍。
离心方法——差速离心
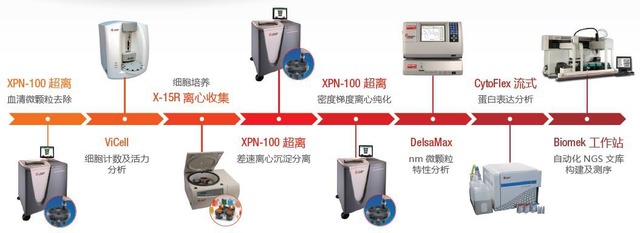
差速离心法 (differebtial velocity centrifugation method) 又称离心力差分离法。原理是利用样品中各组分沉降系数的差异,对不同的微粒施以不同的离心力,经过多次离心,离心速度逐步加大,将不同的微粒依次沉降,从而实现离心分离。如果分离样品中有大中小三种不同粒径的微粒,对它们施以不同的离心力,大粒径的微粒,其质量较大,首先沉降。分离上清液,以更大转速对上清液进行第二次离心,中颗粒被分离出来。再取上清以更大离心力,更高的转速,最后沉降小颗粒,以达到不同颗粒的分离,如图 1 所示。由于在每种颗粒的沉淀物中总含有部分次级颗粒,如想将某种颗粒提纯,需对该颗粒的沉淀物进行稀释后再离心沉淀,最终可制备出理想纯度的颗粒。
由于小粒径的微粒质量小,分离时所需离心力大。为满足大离心力的需要,必需提高其旋转速度,方可分离。以不同的离心力分离不同粒径的微粒是动力学的分离方法。特别是沉降速度差别较大的微粒多采用此种分离方法。差速离心原理可用离心力表达式说明。F=ma 其中 a=ω2R
差速离心主要用于分离直径和密度差异较大的颗粒。差速离心法的优点是分离时间短、重复性高,样品处理量大,可用于大量样品的初分离。其缺点是分离复杂样品和要求分离纯度较高时,离心次数多,操作繁杂。由于沉淀的多次清洗、溶解、再沉淀,容易引起中间损失,所以离心分辨力差。实际分离时由于离心时的对流、扩散和收取沉淀时的污染,对于一些沉降系数相差不大的组分无法进行完全的分离提纯。样品的纯度和回收率都不理想,因此差速离心法主要用于大量样品的初步分离提纯。
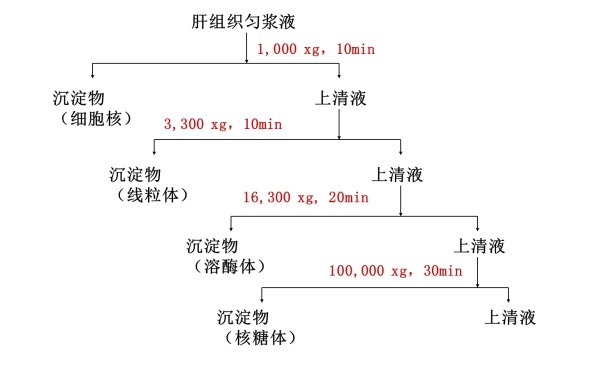
例如,我们可以对动物肝组织匀浆液进行多次的不同相对离心力和时间的离心和沉淀/上清分步收集,得到样品的细胞核、线粒体、溶酶体和核糖体等的初步分离富集沉淀,用于下一步的其他检测或者精细纯化实验。具体的处理流程如下:
离心方法——速率区带离心法
密度梯度离心(isodensity centrifugation method)又称为区带离心。离心时先将样品溶液置于一个由惰性梯度材料形成的密度梯度液体柱中,离心后被分离组分以区带层分布于梯度柱中。该方法的优点是可以同时使样品中几种或全部组分分离,具有良好的分辨率,分离效果好,可一次获得较纯组分。缺点是离心时间较长,需制备梯度液,操作要求高。按照离心分离原理,密度梯度离心又可分为速率区带离心法(rate zonal centrifugation method,R-Z)又称连续密度梯度离心法和等密度离心法 (isopycnic centrifugation method) 又称不连续密度梯度离心法。
速率区带离心也可称为等区密度离心,是根据样品中不同组分粒子所具有的不同的体积大小和不同的沉降系数将混合样品进行离心分离提纯。离心时将需要分离的样品溶液置于由密度梯度材料,如蔗糖、氯化铯 (CsCI)、溴化钠等形成的梯度液柱上面,样品粒子的密度必须大于梯度液柱中任一点的密度,否则得不到理想的区带离心效果。离心时,混合样品中不同的组分将在梯度液柱的不同位置分别形成各自的区带,选择适合的转速和时间进行离心,当各组分区带距离拉得最远时,结束离心,然后将区带取出。这样只需通过一次离心就可以把混合样品中的各组分分离提纯,其纯度和回收率均可满足要求。优点是一次分离纯化,组分的沉降系数相差 20% 以上的即可选用此法,分辨力高,操作熟练可以将组分沉降系数相差 5%~10% 的样品很好的分离。缺点是材料的条件限制,样品液浓度不能太高,否则操作条件很难控制,同时此法与差速离心法相比,处理样品的量要小的多。
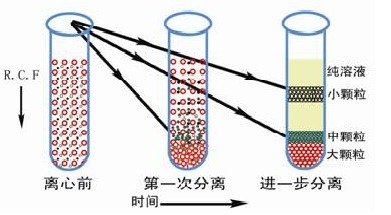
速率区带离心的时间必须严格控制,不能太短,否则样品区带不清,时间也不能太长,否则待分离组分可能沉底。需要分离的样品颗粒的沉降速度取决丁颗粒形状、大小、密度及离心力等因素。离心前后样品的状态如图 2 所示。
速率区带离心最经典的应用就是通过蔗糖密度梯度离心,进行各种亚细胞器(核糖体、线粒体、Exosome 等)和病毒颗粒(病毒载体、疫苗等)的纯化。例如,我们在上一期中得到的 70S 核糖体沉淀,经过水解后,可利用蔗糖密度梯度离心,进一步分离纯化得到 50S 和 30S 的两个亚基。具体的实验流程如下:
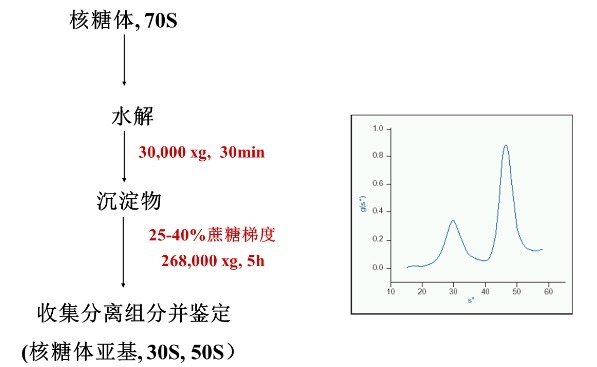
离心方法——等密度梯度离心法
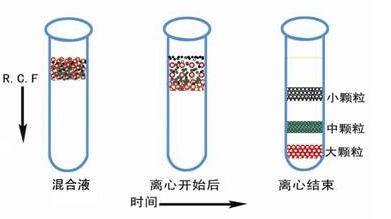
等密度梯度离心也称为平衡密度梯度离心。等密度梯度离心是根据样品中各组分的浮力密度差不同进行分离。在离心立场中,溶液中颗粒浮力密度小则上浮,浮力密度大则下沉,上浮和下沉的颗粒会一直延梯度液移动到与其浮力密度恰好相等的位置上,该位置也称颗粒的等密度点,离心时样品各组分颗粒将按其密度大小分别移至等密度点形成区带,形成的区带不会因离心时间长而发生变化。离心后收集所需区带颗粒即为纯化组分。离心前后样品的状态如图 5-3 所示。
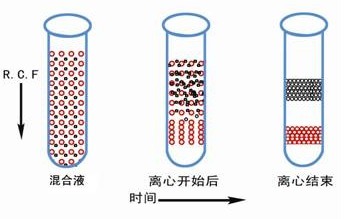
因此,在离心前,样品可置于梯度液的任意位置,一般是均匀分布在梯度液中。等密度区带离心法的离心效果取决于样品颗粒的浮力密度差,密度差越大,分离效果越显著,与样品颗粒的大小与现状无关。
速率区带离心和等密度区带离心都需预准备梯度液。速率区带离心的梯度液密度必须小于待分离组分中最小颗粒的浮力密度。利用颗粒形状和大小差异而形成的沉降速率不同达到分离目的。等密度区带离心是一种平衡离心方法,利用颗粒密度差进行分离,与颗粒形状和大小无关,处理量比差速离心法大。
等密度梯度离心经常使用的梯度液包括氯化铯 (CsCI)、溴化钠等,典型的应用包括质粒 DNA(或者其他 DNA、RNA 核酸片段)的大规模高纯度纯化,脂蛋白的分离纯化等。
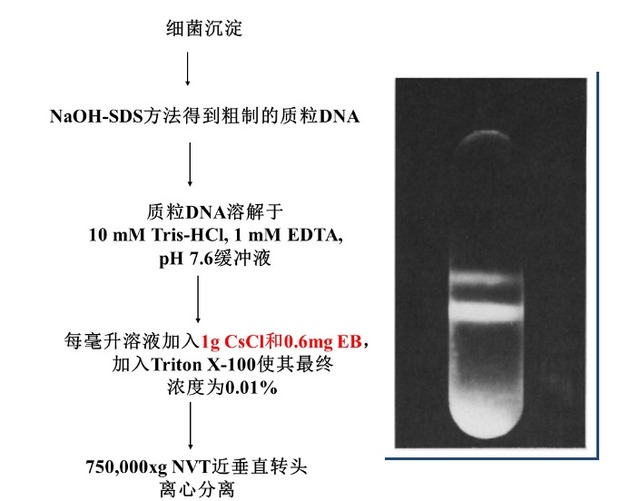
质粒 DNA 的氯化铯等密度梯度离心分离纯化流程如下:
脂蛋白溴化钠等密度梯度离心分离纯化流程如下:
1) 人全血 1000 g 离心 10 分钟去除各种血细胞,上清为血清。
2) 血清加入 NaBr 密度梯度液(不连续梯度)的底部,往上依次铺浓度变小的梯度液。
3) 然后在水平转头中,260,000 g 离心力 14℃ 下离心 24 小时,各种密度的脂蛋白从管底浮向它们自己的等密度区形成了纯的各种密度脂蛋白区。而离心管底部保留着各种血清蛋白。
4) 用上排法从离心管中抽出格层液体,经 DU 核酸蛋白分析仪测定,定位各种不同密度血清脂蛋白。
(本文转载丁香通)