

提取RNA原理
原理:
1.细胞在Trizol的作用下迅速破裂,样品匀浆化,使细胞内含物被溶解的同时,其中的RNA酶抑制剂能够保持RNA的完整性;
2.利用氯仿进行变性蛋白-抽提苯酚-分层(水相-蛋白质中间层-有机相)、乙醇沉淀RNA、吸附柱吸附分离RNA、Buffer缓冲液洗涤RNA。
操作步骤:
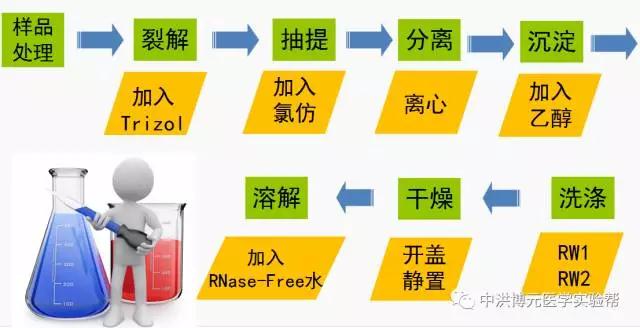
关键点:
样品细胞或组织的有效破碎,即裂解完全;
加入氯仿后,剧烈震荡充分;
对RNA酶的抑制;
提取RNA时,全程使用冰盒,RNA/miRNA保存于低温,最好-80℃,否则容易降解;
实验所用试剂均在有效期或反应成分仍有效(试剂盒、氯仿等)。
测定浓度纯度操作
1.UV-1600PC紫外分光光度计开机预热20min;
2.设定紫外波长 260nm,用ddH2O洗涤比色皿,向比色皿中加入 50ul ddH2O,放入样品室的S池架上,校零;
3.将待测样品稀释(RNA 5ul用ddH2O稀释至50μl)混匀后,记录编号和稀释倍数;
4.把混匀的待测样品移入干净的比色皿中,放进样品室的S架上,记录稳定的OD260(A260)的值;
5.以同样的方式测待测样品在280nm下的OD值;
6.计算待测样品的浓度与纯度:
RNA样品的浓度(ng/μl)=OD260×稀释倍数×40;
纯度=OD260/OD280
举例
某客户某一组样品RNA测得OD260=1.016Abs,OD280=0.533Abs,根据计算公式可得:RNA浓度 1.016×40×10=406.4 ng/ul;RNA纯度 1.016/0.533=1.906此浓度和纯度均适合做PCR。
问题分析
(1)蛋白质污染:确保不要吸入中间层及有机相。减少起始样品量,确保裂解完全、彻底。加入氯仿后首先要充分混匀,并且离心分层的离心力和时间要足够。如果所得RNA的OD260/OD280比值偏低,则用氯仿重新抽提一次,再沉淀,溶解。
(2)苯酚残留:确保不要吸入中间层及有机相。加入氯仿后首先要充分混匀,并且离心分层的离心力和时间要足够。
(3)多糖或多酚的残留:一些特殊的组织和植物中,多糖、多酚含量较多,这些残留也会导致OD260/OD280比值偏低。因此,从这类材料中提取RNA时,需要注意多糖、多酚杂质的去除。
(4)设备限制:测定OD260及OD280数值时,要使OD260读数在0.1-0.5之间,此范围线性最好。用水稀释样品:测OD值时,对照及样品稀释液请使用10 mM Tris,pH7.5。用水作为稀释液将导致比值偏低。
3
合成cDNA
将 RNA 模板、Primer Mix、dNTP Mix、DTT、5xRT Buffer、HiFiScript 和 RNase-Free Water 溶解并置于冰盒上备用。
根据以下表格配制反应体系,总体积为20ul.
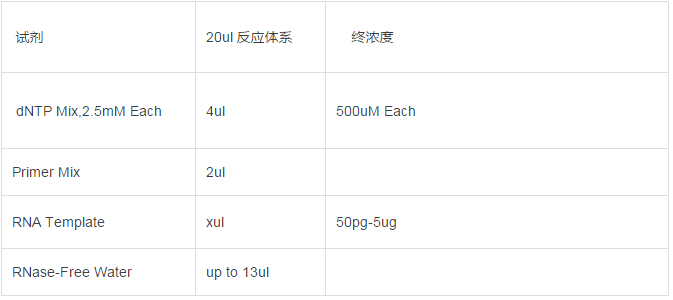
70℃孵育 10min,迅速冰浴 2min。短暂离心,使管壁上的溶液收集到管底。继续向以上反应液中加入以下试剂:
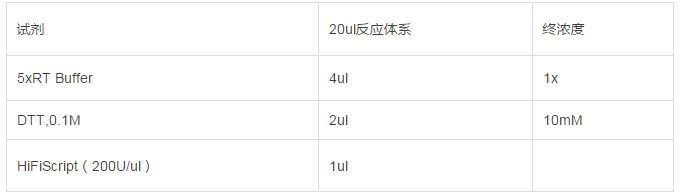
50℃孵育15min,85℃孵育 5min。反应结束后,短暂离心,置于冰上冷却。
逆转录产物可直接用于PCR反应和荧光定量PCR反应,加入量小于PCR反应体系的1/10,或置于-20℃长期保存。
注意事项:
1.加入各种逆转录试剂及RNA时,在冰盒上操作,以防RNA降解;
2.加入试剂后,分别进行各阶段的水浴,确保温度、时间,已便于酶促反应完全。
2
PCR
PCR由模板DNA的变性→模板DNA与引物的退火→引物的延伸三个基本反应步骤构成
根据实验要求,从NCBI库中查找相应引物的基因序列,利用primer premier5软件查找出引物序列,按照设计原则,择优而选。
操作体系:
(1)配制成25ulPCR反应体系如下:
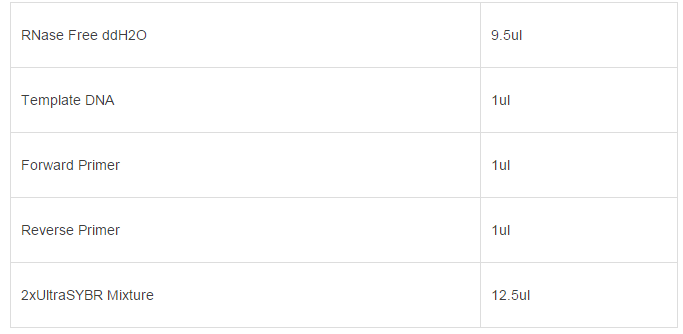
(2)PCR扩增条件:设置梯度退火温度查找
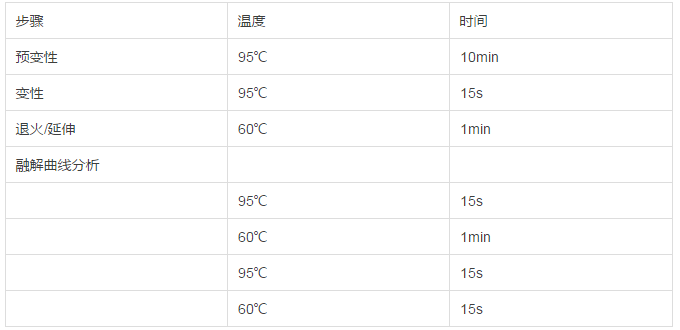
PCR主要影响因素:(1)RNA浓度、纯度(2)退火温度的设置(3)引物设计